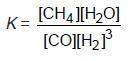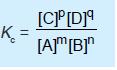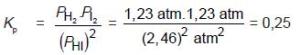Reaksi-reaksi yang dilakukan di laboratorium pada umumnya berlangsung
satu arah. Tetapi ada juga reaksi yang dapat berlangsung dua arah atau dapat
balik. Reaksi searah disebut juga reaksi irreversibel. Reaksi dapat balik atau dapat
berubah lagi menjadi zat-zat semula disebut juga reaksi reversibel.
Reaksi dapat balik yang terjadi dalam satu sistem dan laju reaksi ke arah hasil
atau sebaliknya sama disebut reaksi dalam keadaan setimbang atau reaksi
kesetimbangan. Reaksi kesetimbangan banyak terjadi pada reaksi-reaksi dalam
wujud gas. Sistem yang termasuk reaksi kesetimbangan disebut sistem
kesetimbangan
A. Reaksi Kesetimbangan
Sebelum mempelajari reaksi kesetimbangan, kita perhatikan dulu contoh
reaksi searah dan reaksi dapat balik.
Contoh reaksi searah yaitu reaksi antara batu pualam dengan asam klorida
dengan reaksi: CaCO3(s) + 2 HCl(aq) →CaCl2(aq) + CO2(g) + H2O(l). Kalau kita
reaksikan lagi hasil reaksi tersebut tidak akan kembali lagi. Reaksi ini disebut juga
reaksi berkesudahan.
Contoh reaksi dapat balik yaitu pemanasan kristal tembaga(II) sulfat hidrat.
Kristal tembaga(II) sulfat hidrat berwarna biru jika dipanaskan akan berubah
menjadi tembaga(II) sulfat berwarna putih.
Jika pada tembaga (II) sulfat diteteskan air maka akan berubah lagi menjadi
tembaga(II) sulfat hidrat. Reaksinya ditulis sebagai berikut.
CuSO4.5 H2O(s) → CuSO4(s) + 5 H2O(g)
biru putih
CuSO4(s) + 5 H2O(l) → CuSO4.5 H2O(s)
putih biru
Reaksi yang dapat balik, dapat ditulis dengan tanda panah yang berlawanan,
(↔ ). Persamaan reaksi di atas dapat ditulis:
CuSO4.5 H2O(s)→ CuSO4(s) + 5 H2O(l)
Setelah mempelajari reaksi searah dan reaksi dapat balik, sekarang kita
pelajari reaksi kesetimbangan.
Coba perhatikan reaksi antara larutan besi(III) klorida dengan larutan kalium
tiosianat yang menghasilkan ion besi(III) tiosianat.

Ditinjau dari reaksi searah maka kedua pereaksi tersebut akan habis karena
jumlah mol zat yang bereaksinya sama. Apa yang terjadi apabila pada zat hasil
reaksi ditambahkan 1 tetes larutan FeCl3 1 M atau 1 tetes larutan KSCN 1 M?
Apakah ada perubahan warna? Jika terjadi, mengapa?
Pada penambahan ion SCN– warna merah bertambah tua berarti terbentuk
lagi ion Fe(SCN)2+, atau ion SCN– yang ditambahkan bereaksi lagi dengan ion Fe3+.
Darimana ion Fe3+? Menurut perhitungan jika 10 mL larutan FeCl3 0,001 M bereaksidengan 10 mL KSCN 0,001 M kedua zat akan habis bereaksi atau ion Fe2+ dan ionSCN– sudah habis bereaksi. Demikian pula pada penambahan ion Fe3+ akanterbentuk kembali Fe(SCN)2+, berarti ion Fe3+ bereaksi lagi dengan ion SCN–.
Darimana ion SCN– tersebut? Dari data percobaan tersebut dapat disimpulkan ionFe3+ dan ion SCN– selalu ada pada sistem karena Fe(SCN)2+ secara langsung
dapat terurai lagi menjadi ion Fe3+ dan ion SCN–.
Oleh karena reaksi tersebut terjadi pada sistem tertutup maka reaksi ini
disebut reaksi kesetimbangan.
Reaksinya ditulis:
Fe3+(aq) + SCN–(aq)→ Fe(SCN)2+(aq)
Pada reaksi ini pembentukan Fe(SCN)2+ dan penguraiannya menjadi ion Fe3+
dan SCN– tidak dapat diamati karena berlangsung pada tingkat partikel. Reaksi ini
disebut juga reaksi kesetimbangan dinamis.
Ciri-ciri keadaan setimbang dinamis adalah sebagai berikut.
1. Reaksi berlangsung terus-menerus dengan arah yang berlawanan.
2. Terjadi pada ruangan tertutup, suhu, dan tekanan tetap.
3. Laju reaksi ke arah hasil reaksi dan ke arah pereaksi sama.
4. Tidak terjadi perubahan makroskopis, yaitu perubahan yang dapat diukur atau
dilihat, tetapi perubahan mikroskopis (perubahan tingkat partikel) tetap
berlangsung.
5. Setiap komponen tetap ada.
Reaksi kesetimbangan dinamis yaitu reaksi yang berlangsung terus-menerus
dengan arah yang berlawanan dan kecepatan yang sama. Dalam kehidupan
sehari-hari, contoh reaksi kesetimbangan dinamis dapat dilihat pada permainan
sirkus seperti Gambar

Pada permainan sirkus, ada seekor
burung yang mencoba berjalan pada
roda yang berputar. Burung berjalan ke
kiri, sedangkan roda berputar ke kanan.
Jika kecepatan roda ke kanan sama
dengan kecepatan burung berjalan,
maka posisi burung itu akan tetap dan
kelihatan diam.
Kejadian itu disebut keadaan setimbangdinamis sebab burung kelihatan
diam padahal kakinya berjalan terus
dengan arah yang berlawanan dengan
roda berputar.
Pada saat setimbang, ada beberapa kemungkinan yang terjadi dilihat dari
konsentrasi pereaksi atau hasil reaksi pada saat itu.Contoh:
Pada reaksi A + B→ C + D ada 3 kemungkinan yang terjadi yaitu sebagai baeikut
Kemungkinan I ditunjukkan pada
Gambar
a. Mula-mula konsentrasi A dan B harganya
maksimal, kemudian berkurang
sampai tidak ada perubahan.
b. Konsentrasi C dan D dari nol
bertambah terus sampai tidak ada
perubahan.
c. Pada saat setimbang, konsentrasi C
dan D lebih besar daripada A dan B.
Kemungkinan II ditunjukkan pada
Gambar 5.4.
Perubahan konsentrasi A dan B menjadi
C dan D sama seperti kemungkinan I.
Pada saat setimbang, konsentrasi C dan
D lebih kecil daripada A dan B
Kemungkinan III ditunjukkan pada
Gambar 5.5.
Perubahan konsentrasi A dan B
menjadi C dan D sama seperti kemungkinan
I dan II, tetapi pada saat setimbang
konsentrasi A dan B sama dengankonsentrasi C dan D.
B. Reaksi Kesetimbangan Homogen dan Reaksi
Kesetimbangan Heterogen
Berdasarkan wujud zatnya reaksi kesetimbangan dikelompokkan menjadi
kesetimbangan homogen dan kesetimbangan heterogen.
1. Kesetimbangan Homogen
Kesetimbangan homogen adalah sistem kesetimbangan yang komponennya
mempunyai wujud yang sama.
Contoh:
a. Reaksi kesetimbangan yang terdiri atas gas-gas
2 SO2(g) + O2(g) ↔2 SO3(g)
N2(g) + 3 H2(g) 2↔ NH3(g)
b. Reaksi kesetimbangan yang terdiri atas ion-ion
Fe3+(aq) + SCN–(aq)↔ Fe(SCN)2+(aq)
c. Reaksi kesetimbangan yang terdiri atas zat berwujud cair
CH3COOH(l) + CH3CH2OH(l)↔ CH3COOCH2CH3(l) + H2O(l)
2. Kesetimbangan Heterogen
Kesetimbangan heterogen adalah sistem kesetimbangan yang komponennya
terdiri atas zat-zat dengan wujud yang berbeda.
Contoh:
a. Reaksi kesetimbangan yang terdiri atas zat cair, gas, dan larutan
Reaksi: CO2(g) + H2O(l)↔ H2CO3(aq)
b. Reaksi kesetimbangan yang terdiri atas zat padat dan gas
C(s) + 2 N2O(g)↔ CO2(g) + 2 N2(g)
c. Reaksi kesetimbangan yang terdiri atas zat padat, cair, dan gas
ICI(l) + Cl2(g)↔ ICl3(g)
Faktor-Faktor yang Mempengaruhi Reaksi Kesetimbangan
Azas Le Chatelier yang berbunyi:
Jika suatu sistem kesetimbangan menerima suatu aksi maka sistem tersebut
akan mengadakan reaksi, sehingga pengaruh aksi menjadi sekecil-kecilnya
Faktor-faktor yang dapat mempengaruhi sistem kesetimbangan adalah perubahansuhu, perubahan konsentrasi, perubahan tekanan, dan perubahan volum
1. Pengaruh Perubahan Suhu pada Kesetimbangan
Reaksi kesetimbangan dapat merupakan reaksi eksoterm maupun endoterm.
Pada reaksi-reaksi ini perubahan suhu sangat berpengaruh. Contohnya pada
reaksi kesetimbangan antara gas nitrogen dioksida dan dinitrogen tetraoksida
dengan reaksi:
2 NO2(g) ↔ N2O4(g) ΔH = –59,22 kJ
coklat tak berwarna
t = 0°C t = 25°C t = 10°C
Pada suhu kamar, sistem kesetimbangan tersebut berwarna coklat. Bagaimana
jika sistem kesetimbangan ini suhunya diubah?
Perhatikan gambar percobaan berikut ini!
Berdasarkan percobaan di atas diperoleh data sebagai berikut.
a. Jika suhu dinaikkan, warna coklat bertambah artinya gas NO2 bertambah.
b. Jika suhu diturunkan, warna coklat berkurang artinya gas N2O4 bertambah.
Dengan melihat reaksi eksoterm dan endoterm pada reaksi tersebut, maka
dapat disimpulkan:
• Jika suhu dinaikkan, kesetimbangan bergeser ke arah reaksi endoterm.
• Jika suhu diturunkan, kesetimbangan bergeser ke arah reaksi eksoterm.
Contoh:
a. Pada reaksi 2 CO2(g)→ 2 CO(g) + O2(g) ΔH° = +566 kJ
Jika suhu diturunkan, kesetimbangan akan bergeser ke arah CO2.
Jika suhu dinaikkan, kesetimbangan akan bergeser ke arah CO dan O2.
b. CO(g) + H2O(g)→ CO2(g) + H2(g) ΔH = -41 kJ
Jika suhu diturunkan, kesetimbangan akan bergesar ke arah CO2 dan H2.
Jika suhu dinaikan, kesetimbangan akan bergeser ke arah CO dan H2O.
2. Pengaruh Perubahan Konsentrasi pada Tekanan
Untuk mempelajari pengaruh perubahan konsentrasi pada kesetimbangan,
perhatikan percobaan penambahan ion-ion dan zat lain pada sistem kesetimbangan
berikut.
Fe3+(aq) + SCN–(aq) ↔ Fe(SCN)2+(aq)
coklat tak berwarna merah
Pengaruh Perubahan Konsentrasi
Percobaan ini bertujuan untuk mengamati pengaruh perubahan konsentrasi
terhadap pergeseran kesetimbangan pada reaksi ion Fe3+ dan ion SCN–.
Alat dan bahan:
1. Gelas kimia 100 mL 5. Larutan FeCl3 0,2 M
2. Tabung reaksi 6. Larutan KSCN 0,2 M
3. Rak tabung 7. Kristal Na2HPO4
4. Pipet tetes 8. Air mineral
Langkah kerja:
1. Isi gelas kimia dengan 25 mL, air tambahkan 5 tetes FeCl3 0,2 M dan
5 tetes KSCN 0,2 M aduk sampai rata. Amati warna larutan.
2. Tuangkan larutan tersebut ke dalam 5 buah tabung reaksi yang sama
volumnya dan beri nomor tabung 1 sampai dengan 5.
3. • Pada tabung 2 tambahkan 5 tetes larutan FeCl3 0,2 M.
• Pada tabung 3 tambahkan 5 tetes larutan KSCN 0,2 M.
• Pada tabung 4 tambahkan 2 serbuk Na2HPO4.
• Pada tabung 5 tambahkan 5 mL air.
4. Bandingkan warna larutan yang terjadi pada tabung 2, 3, 4, dan 5
dengan warna larutan asal pada tabung 1.Pada tabung ke-5 warna
larutan dilihat dari atas tabung.
6. Catat hasil pengamatan pada sebuah tabel.
Pertanyaan:
1. Jelaskan apa yang menyebabkan terjadinya perubahan warna pada
percobaan di atas!
2. Jelaskan bagaimana pengaruh penambahan atau pengurangan
konsentrasi pereaksi pada percobaan di atas!
3. Jelaskan apakah penambahan air pada tabung 5 mempengaruhi
sistem kesetimbangan!
Sesuai dengan azas Le Chatelier jika salah satu zat konsentrasinya diperbesar,
reaksi akan bergeser ke arah yang berlawanan, jika salah satu zat konsentrasinya
diperkecil, reaksi akan bergeser kearah zat tersebut.
Perhatikan reaksi kesetimbangan berikut.
Fe3+(aq)+ SCN–(aq)↔ FeSCN–(aq)
coklat tak berwarna merah
Pada percobaan ini didapat bahwa penambahan ion Fe3+ dan SCN–
menyebabkan larutan standar menjadi lebih merah, berarti ion Fe(SCN)2+bertambah.
Pada kesetimbangan ini adanya penambahan ion Fe3+ dan ion SCN–menyebabkan
kesetimbangan bergeser ke arah ion Fe(SCN)2+.
Pada penambahan kristal Na2HPO4, mengakibatkan warna merah pada
larutan berkurang, sebab jumlah ion Fe(SCN)2+ berkurang. Mengapa ion Fe(SCN)2+
berkurang?
Kristal Na2HPO4 berfungsi untuk mengikat ion Fe3+, maka untuk menjaga
kesetimbangan, ion Fe(SCN)2+ akan terurai lagi membentuk ion Fe3+ dan SCN–
atau kesetimbangan bergeser ke arah ion Fe3+ dan SCN–.
Dari eksperimen di atas dapat disimpulkan:
• Jika pada sistem kesetimbangan salah satu komponen ditambah,
kesetimbangan akan bergeser ke arah yang berlawanan.
• Jika pada sistem kesetimbangan salah satu komponennya dikurangi ,
kesetimbangan akan bergeser ke arah komponen tersebut
Contoh:
a. N2(g) + 3 H2(g)→ 2 NH3(g)
• Jika gas N2 ditambah, kesetimbangan akan bergeser ke arah NH3.
• Jika gas N2 dikurangi, kesetimbangan akan bergeser ke arah N2.
b. 2 HCl(g)→ H2(g) + Cl2(g)
• Jika gas HCl ditambah, kesetimbangan bergeser ke arah H2 dan Cl2.
• Jika gas HCl dikurangi, kesetimbangan bergeser ke arah H
3. Pengaruh Perubahan Tekanan pada Kesetimbangan
• Jika tekanan diperbesar, kesetimbangan akan bergeser ke arah komponen
yang jumlah molnya lebih kecil.
• Jika tekanan diperkecil, kesetimbangan akan bergeser ke arah komponen
yang jumlah molnya lebih besar
Contoh:
a. Reaksi: N2(g) + 3 H2(g) →2 NH3(g).
Pada reaksi di atas, jika tekanan diperbesar, kesetimbangan bergeser ke arah
gas NH3serta jika tekanan diperkecil, kesetimbangan bergeser ke arah gas N2
dan H2.
b. Reaksi:H2(g) + I2(g)→ 2 HI(g)
Perubahan tekanan pada kesetimbangan di atas tidak menyebabkan
pergeseran kesetimbangan, sebab jumlah mol pereaksi sama dengan mol
hasil reaksi.
c. Reaksi: C(s) + 2 N2O(g)→ CO2(g) + 2 N2(g)
Tekanan tidak mempengaruhi komponen yang berwujud padat atau cair.
Pada kesetimbangan di atas, jika tekanan diperbesar kesetimbangan akan
bergeser ke arah gas N2O dan jika tekanan diperkecil kesetimbangan akan
bergeser ke arah gas CO2 dan N2.
4. Pengaruh Perubahan Volum pada Kesetimbangan
Perubahan volum pada kesetimbangan bergantung pada komponennya, baik
komponen gas atau komponen ion-ion.
a. Perubahan Volum pada Kesetimbangan yang Komponennya Gas
Untuk komponen gas,
• jika volum diperbesar maka kesetimbangan bergeser ke arah komponen
yang jumlah molnya besar.
• jika volum diperkecil maka kesetimbangan bergeser ke arah komponen
yang jumlah molnya kecil
Contoh:
1) PCl5(g)↔ PCl3(g) + Cl2(g)
• Jika volum diperbesar, kesetimbangan akan bergeser ke arah gas PCl3
dan Cl2.
• Jika volum diperkecil, kesetimbangan akan bergeser ke arah gas PCl5.
2) C(s) + CO2(g)↔ 2CO(g)
• Jika volum diperbesar, kesetimbangan akan bergeser ke arah gas CO.
• Jika volum diperkecil, kesetimbangan akan bergeser ke arah CO2
b. Perubahan Volum pada Kesetimbangan yang Komponen-
Komponennya Berupa Ion-Ion
Untuk mempelajari pengaruh perubahan volum pada kesetimbangan ini,
salah satu contohnya pengenceran pada kesetimbangan:
Fe2+(aq) + SCN–(aq)↔ Fe(SCN)2+(aq)
tidak berwarna merah
Pengenceran pada kesetimbangan ini mengakibatkan warna merah berkurang
atau kesetimbangan bergeser ke arah ion Fe2+ dan SCN–.
Pengenceran pada larutan menyebabkan volum menjadi besar, maka untuk
kesetimbangan yang jumlah mol atau jumlah partikel pereaksi dan hasil reaksinyaberbeda,kesetimbangan akanbergeser ke arah partikel yang jumlahnya lebih besar
5. Reaksi Kesetimbangan dalam Industri
a. Pembuatan Amonia
Amonia (NH3) merupakan senyawa nitrogen yang banyak digunakan sebagai
bahan dasar pembuatan pupuk urea dan ZA, serat sintetik (nilon dan sejenisnya),
dan bahan peledak TNT (trinitro toluena). Pembuatan amonia yang dikemukakan
oleh Fritz Haber (1905), prosesnya disebut Proses Haber. Reaksi yang terjadi
adalah kesetimbangan antara gas N2, H2, dan NH3 ditulis sebagai berikut.
N2(g) + 3 H2(g) 2↔ NH3(g) ΔH = –92 kJ
Untuk proses ini, gas N2 diperoleh dari hasil penyulingan udara, sedangkan
gas H2 diperoleh dari hasil reaksi antara gas alam dengan air. Pada suhu kamar,
reaksi ini berlangsung sangat lambat maka untuk memperoleh hasil yang maksimal,reaksi dilakukan pada suhu tinggi, tekanan tinggi, dan diberi katalis besi.
Reaksi pembentukan amonia merupakan reaksi eksoterm. Menurut Le Chatelier
kesetimbangan akan bergeser ke arah NH3 jika suhu rendah. Masalahnya adalah
katalis besi hanya berfungsi efektif pada suhu tinggi, akibatnya pembentukan
amonia berlangsung lama pada suhu rendah.
Berdasarkan pertimbangan ini proses pembuatan amonia dilakukan pada
suhu tinggi ±450°C (suhu optinum) agar reaksi berlangsung cepat sekalipun
dengan resiko kesetimbangan akan bergeser ke arah N2dan H2. Untuk mengimbangi
pergeseran ke arah N2 dan H2 oleh suhu tinggi, maka tekanan yang digunakan
harus tinggi sampai mencapai antara 200–400 atm. Tekanan yang tinggi
menyebabkan molekul-molekul semakin rapat sehingga tabrakan molekul-molekul
semakin sering. Hal ini mengakibatkan reaksi bertambah cepat, sehingga NH3
semakin banyak terbentuk. Selain itu untuk mengurangi NH3 kembali menjadi N2dan H2 maka NH3 yang terbentuk segera dipisahkan.
Campuran gas kemudian didinginkan sehingga gas NH3 mencair. Titik didih
gas NH3 lebih tinggi dari titik didih gas N2 dan H2, maka gas NH3 akan terpisah
sebagai cairan. Gas nitrogen dan gas hidrogen yang belum bereaksi dan gas NH3
yang tidak mencair diresirkulasi, dicampur dengan gas N2 dan H2, kemudian
dialirkan kembali ke dalam tangki.
Bagan pembuatan amonia secara sederhana dapat dilihat pada Gambar

b. Pembuatan Asam Sulfat
Salah satu cara pembuatan asam sulfat secara industri yang produknya cukup
besar adalah dengan proses kontak. Bahan yang digunakan pada proses ini
adalah belerang dan prosesnya berlangsung sebagai berikut.
1) Belerang dibakar di udara sehingga akan bereaksi dengan oksigen dan
menghasilkan gas belerang dioksida.
Reaksi: S(s) + O2(g) ↔ SO2(g)
2) Belerang dioksida direaksikan lagi dengan oksigen dan dihasilkan belerang
trioksida.
Reaksi: 2 SO2(g) + O2(g) 2 SO3(g) ΔH = –196,6 kJ.
Reaksi ini merupakan reaksi kesetimbangan dan eksoterm sehingga suhu
tidak dilakukan pada suhu tinggi tetapi ±450°C, untuk menghindari
kesetimbangan ke arah SO2 dan O2.
3) Reaksi ini berlangsung lambat, maka dipercepat dengan katalis. Katalis yang
digunakan adalah vanadium pentaoksida (V2O5).
4) Tekanan seharusnya lebih tinggi, tetapi pada prakteknya karena ada katalis
maka SO3 sudah cukup banyak terbentuk sehingga tekanan dilakukan pada
keadaan normal yaitu 1 atm.
5) SO3 yang dihasilkan segera dipisahkan sehingga kesetimbangan bergeser
terus ke arah SO3. SO3 yang dihasilkan direaksikan dengan H2SO4 pekat dan
membentuk asam pirosulfat (H2S2O7). Asam pirosulfat akan direaksikan
dengan air sampai menghasilkan asam sulfat ±98%.
Reaksi:
SO3(g) + H2SO4(aq) ↔ H2S2O7(aq)
H2S2O7(aq) + H2O(l) ↔2 H2SO4(l)
D. Konstanta Kesetimbangan
Menurut Gulberg dan Waage, pada suhu tetap harga konstanta kesetimbangan
akan tetap. Hal ini dirumuskan sebagai Hukum Kesetimbangan yang berbunyi
sebagai berikut.
Pada reaksi kesetimbangan, hasil kali konsentrasi zat hasil reaksi yang
dipangkatkan koefisiennya dibagi dengan hasil kali konsentrasi zat pereaksi
yang dipangkatkan koefisiennya akan tetap, pada suhu tetap.
Untuk lebih memahami tentang hukum ini, perhatikan data beberapa harga
konstanta kesetimbangan reaksi antara CO dengan H2 pada suhu tetap dengan
konsentrasi yang berbeda pada Tabel 5.1.
Reaksinya: CO(g) + 3 H2(g)↔ CH4(g) + H2O(g) T = 1200 K
1. Konstanta Kesetimbangan Berdasarkan Konsentrasi
Konstanta kesetimbangan berdasarkan konsentrasi dinyatakan dengan notasi
Kc, yaitu hasil kali konsentrasi zat-zat hasil reaksi dibagi hasil kali zat-zat pereaksi,
setelah masing-masing konsentrasi dipangkatkan koefisiennya pada reaksi tersebut.
Jadi, pada kesetimbangan m A(g) + n B(g) p C(g) + q D(g), harga KC adalah:
Contoh Soal
1. Tentukan harga Kc dari reaksi kesetimbangan PCl5(g)↔ PCl3(g) + Cl2(g), jika
diketahui data konsentrasi zat-zat pada kesetimbangan sebagai berikut
2.
Konstanta Kesetimbangan Berdasarkan Tekanan
Konstanta kesetimbangan berdasarkan tekanan dinyatakan dengan simbol
Kp, yaitu hasil kali tekanan parsial gas-gas hasil reaksi dibagi dengan hasil kali
tekanan parsial gas-gas pereaksi, setelah masing-masing gas dipangkatkan
dengan koefisiennya menurut persamaan reaksi. Jadi, konstanta kesetimbangan
pada reaksi: m A(g) + n B(g) p↔ C(g) + q D(g) yaitu:
PA = tekanan parsial A
PB = tekanan parsial B
PC = tekanan parsial C
PD = tekanan parsial D
Tekanan parsial diberi lambang P dan ditentukan dengan rumus:
P = Jumlah mol gas X /Jumlah mol total semua gasx Tekanan total
Untuk menentukan Kp tekanan gas dapat dinyatakan dengan cm Hg atau
atmosfer (atm)
Contoh Soal
1. Pada temperatur 500 K ke dalam bejana yang volumnya 5 liter dimasukkan 0,6
mol gas HI sehingga terjadi reaksi kesetimbangan 2 HI(g) H2(g) + I2(g). Bila
setelah sistem mencapai keadaan kesetimbangan masih terdapat 0,3 mol HI,
tentukan harga konstanta kesetimbangan Kppada temperatur 500 K (R = 0,082).
Penyelesaian:
Persamaan reaksi: 2 HI(g) H2(g) + I2(g)↔HI yang terurai = (0,6 – 0,3) mol = 0,3 mol
HI sisa = 0,3 mol
H2 yang terbentuk = 1/2 .0,3 mol = 0,15 mol
I2 yang terbentuk = 1/2 .0,3 mol = 0,15 mol
Untuk mendapatkan harga P, gunakan rumus: P =n/V.R.T
PHI =0 ,3/5 .0,082. 500 atm = 2,46 atm
PH2 =0 ,15/5.0,082.500 atm = 1,23 atm
PI2 =0 ,15/5 .0,082.500 atm = 1,23 atm
3. Hubungan Kc dengan Kp
Hubungan Kc dengan Kp dapat ditentukan berdasarkan rumus PV = nRT
Jika jumlah koefisien hasil reaksi sama dengan jumlah koefisien pereaksi
(Δn = 0) maka Kp = Kc.
Contoh Soal
1. Pada reaksi setimbang: 2 SO2(g) + O2(g) 2 SO3(g).
Harga Kc = 2,8 x 102, pada 1000 Kelvin. Hitung harga Kp, jika R = 0,082.
Penyelesaian:
Kp = Kc(RT)Δn
Pada reaksi di atas Δn = 2 – (2 + 1) = –1
Dengan demikian harga Kp = 2,8 x 102 (0,082 x 1000)–1 = 3,4
2. Pada suhu 25oC terdapat kesetimbangan : 2 NO(g) + Cl2(g)↔ 2 NOCl(g).
Harga Kc = 4,6 . 10–4, tentukan Kp jika R = 0,082.
Penyelesaian:
Kp = Kc.(RT)Δn
= 4,6 . 10–4 (0,082 x 298)–1
= 1,88 x 10–5
4. Konstanta Kesetimbangan Heterogen
Kesetimbangan heterogen adalah kesetimbangan yang komponennya terdiri
dari zat-zat yang wujudnya berbeda.
Contoh: Br2(l)↔ Br2(g)
CaCO3(s)↔ CaO(s) + CO2(g)
Ag+(aq) + Fe2+(aq)↔ Ag(s) + Fe3+(aq)
Konstanta kesetimbangan untuk reaksi CaCO3(s) ↔CaO(s) + CO2(g)
menurut hukum kesetimbangan adalah
Oleh karena CaCO3 dan CaO berwujud padat yang pada kesetimbangan
dianggap tetap maka konstanta kesetimbangan tersebut menjadi:
Kc = [CO2] dan Kp = PCO2